Los electrones de valencia: descubre su crucial función en el mundo de la química
En el mundo de la química, los electrones de valencia desempeñan un papel fundamental. Son los electrones más externos de un átomo y juegan un papel crucial en la formación de enlaces químicos y en las reacciones químicas. Estos electrones determinan las propiedades químicas y la capacidad de un átomo para participar en interacciones con otros átomos.
Exploraremos en detalle qué son los electrones de valencia y cómo afectan a la química. También veremos cómo los átomos pueden ganar o perder electrones de valencia para alcanzar una configuración electrónica estable, formando así los compuestos químicos. Además, discutiremos la importancia de los electrones de valencia en la determinación de la reactividad de los elementos y cómo se comportan en diferentes clases de elementos en la tabla periódica. En definitiva, descubriremos la crucial función que los electrones de valencia desempeñan en el fascinante mundo de la química.
- Qué son los electrones de valencia y por qué son importantes en química
- Cuál es la relación entre los electrones de valencia y la reactividad de un elemento químico
- Cuántos electrones de valencia tiene cada grupo principal de la tabla periódica
- Cómo se representan los electrones de valencia en un diagrama de Lewis
- Cuáles son las reglas para determinar el número de electrones de valencia de un elemento
- Cómo influyen los electrones de valencia en la formación de enlaces químicos
- Qué son los ejemplos comunes de compuestos químicos que muestran la importancia de los electrones de valencia
- Qué papel juegan los electrones de valencia en la conducción eléctrica
- Cuál es la importancia de los electrones de valencia en la formación de iones
Qué son los electrones de valencia y por qué son importantes en química
Los electrones de valencia son los electrones que se encuentran en el último nivel de energía de un átomo. Son responsables de las propiedades químicas de los elementos y juegan un papel crucial en la formación de enlaces químicos.
En química, los electrones de valencia determinan cómo un átomo interactúa con otros átomos en una reacción química. Estos electrones son los responsables de la formación de enlaces covalentes, iónicos y metálicos, así como de la estabilidad de compuestos y moléculas.
La distribución de los electrones en los diferentes niveles y subniveles de energía se representa mediante la configuración electrónica. Los electrones en los niveles más externos se llaman electrones de valencia, ya que están más involucrados en las interacciones químicas.
Uno de los conceptos claves relacionados con los electrones de valencia es la regla del octeto. La regla del octeto establece que los átomos tienden a ganar, perder o compartir electrones para alcanzar una configuración electrónica similar a la de los gases nobles, que tienen ocho electrones en su capa de valencia.
Esta regla del octeto explica por qué los átomos tienden a formar enlaces químicos. Al ganar, perder o compartir electrones, los átomos pueden adquirir la estabilidad deseada. Por ejemplo, el sodio tiene un solo electrón en su capa de valencia, por lo que tiende a perderlo para alcanzar configuración de gas noble. Mientras tanto, el cloro tiene siete electrones en su capa de valencia y tiende a ganar uno para completar su octeto.
Los electrones de valencia también son importantes para determinar las propiedades físicas y químicas de los compuestos. Por ejemplo, la conductividad eléctrica y térmica de un material está relacionada con la movilidad de los electrones de valencia. Los metales, que tienen una gran cantidad de electrones de valencia libres, son buenos conductores de electricidad, mientras que los no metales, que tienen pocos electrones de valencia libres, son malos conductores.
Los electrones de valencia desempeñan un papel fundamental en la química. Son responsables de las propiedades químicas de los elementos, la formación de enlaces químicos y la estabilidad de compuestos y moléculas. Comprender el comportamiento de los electrones de valencia nos ayuda a comprender las interacciones y reacciones químicas.
Cuál es la relación entre los electrones de valencia y la reactividad de un elemento químico
Los electrones de valencia juegan un papel crucial en la reactividad de los elementos químicos. Para entender su función, es importante comprender qué son los electrones de valencia y cómo interactúan con otros átomos y moléculas.
Los electrones de valencia son los electrones más externos en la configuración electrónica de un átomo. Son aquellos que participan en las interacciones químicas y determinan las propiedades químicas de un elemento. La cantidad de electrones de valencia de un átomo está relacionada con su posición en la tabla periódica.
La reactividad de un elemento químico se debe a su capacidad para ganar o perder electrones de valencia. Los átomos buscan alcanzar una configuración electrónica estable, generalmente similar a la de los gases nobles, que son muy estables debido a su configuración electrónica completa. Aquellos elementos que tienen pocos electrones de valencia tienden a perderlos para alcanzar la estabilidad. Por otro lado, aquellos con mayor cantidad de electronés de valencia tienden a ganar electronés de otros átomos.
Cuando dos átomos se acercan, sus electronés de valencia interactúan entre sí. Si un átomo tiene pocos electrónés de valencia, tiene más probabilidades de perderlos y convertirse en un ion positivo, llamado catión. Por el contrario, si un átomo tiene muchos electronés de valencia, tiene más probabilidades de ganar electrones y convertirse en un ion negativo, conocido como anión.
Esta transferencia de electrones da lugar a la formación de enlaces iónicos, donde los átomos se unen a través de la atracción electrostática entre los iones de carga opuesta. Estos enlaces iónicos son responsables de las propiedades características de muchos compuestos químicos, como la sal de mesa (cloruro de sodio).
Además de la transferencia de electrones, también existen otros tipos de enlaces químicos, como los enlaces covalentes. En estos casos, los átomos comparten pares de electrones de valencia para alcanzar la estabilidad. Los enlaces covalentes son más comunes entre elementos con una cantidad similar de electronés de valencia.
El número de electrónés de valencia también influye en otras propiedades de los elementos, como su punto de ebullición y fusión, su conductividad eléctrica y térmica, su dureza y muchos otros atributos físicos y químicos.
Los electrones de valencia juegan un papel fundamental en la reactividad de los elementos químicos. Son los responsables de la formación de enlaces químicos y determinan muchas de las propiedades características de los compuestos químicos. La cantidad de electrones de valencia de un átomo está relacionada con su posición en la tabla periódica y su capacidad para ganar o perder electrones.
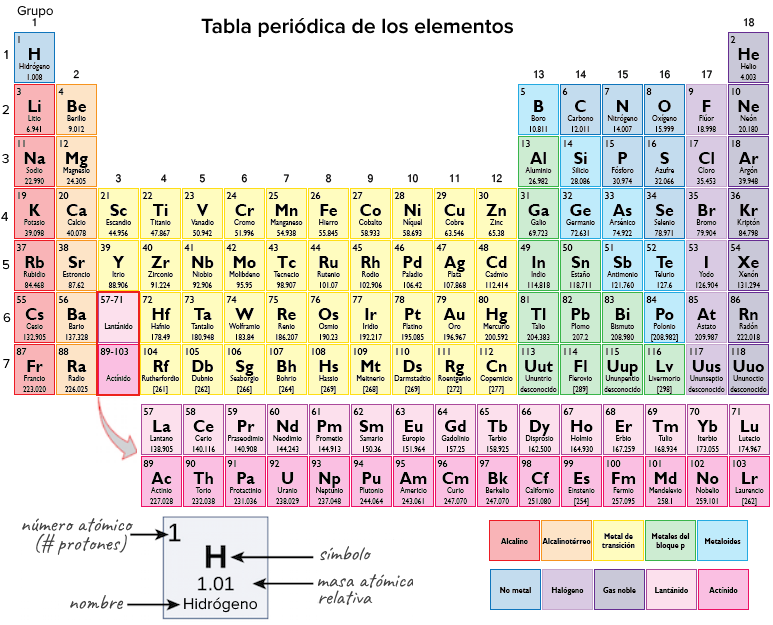
Cuántos electrones de valencia tiene cada grupo principal de la tabla periódica
Los electrones de valencia son los electrones que se encuentran en el nivel más externo, o sea, el nivel de energía más alto, de un átomo. Estos electrones juegan un papel fundamental en la forma en que los átomos interactúan entre sí y en cómo se forman y rompen los enlaces químicos.
Cada grupo principal de la tabla periódica tiene un número específico de electrones de valencia, que determina las propiedades químicas de los elementos en ese grupo. A medida que subimos o bajamos en un grupo, el número de electrones de valencia aumenta o disminuye en función de la estructura electrónica del átomo.
Grupo 1: Metales alcalinos
Los elementos del grupo 1, también conocidos como metales alcalinos, tienen un electrón de valencia. Estos elementos son altamente reactivos y tienden a perder este electrón para formar cationes con carga +1. Algunos ejemplos de elementos en este grupo son el litio (Li), el sodio (Na) y el potasio (K).
Grupo 2: Metales alcalinotérreos
Los elementos del grupo 2, llamados metales alcalinotérreos, tienen dos electrones de valencia. Estos electrones también tienden a perderse, pero no con tanta facilidad como los del grupo 1. Los elementos de este grupo forman cationes con carga +2. Ejemplos de elementos en esta categoría son el calcio (Ca), el magnesio (Mg) y el bario (Ba).
Grupo 13: Familia del boro
Los elementos del grupo 13 tienen tres electrones de valencia. Estos electrones pueden participar en la formación de enlaces covalentes, compartiendo electrones con otros elementos. Aluminio (Al) e indio (In) son algunos ejemplos de elementos de este grupo.
Grupo 14: Familia del carbono
El carbono es el elemento más destacado de esta familia, ya que tiene 4 electrones de valencia. Estos electrones permiten al carbono formar una gran variedad de compuestos, incluyendo hidrocarburos y biomoléculas. Los demás elementos de este grupo, como el silicio (Si) y el germanio (Ge), también tienen 4 electrones de valencia.
Grupo 15: Familia del nitrógeno
Los elementos de este grupo tienen 5 electrones de valencia. Este grupo incluye elementos importantes para la vida, como el nitrógeno (N) y el fósforo (P). El nitrógeno es fundamental en las moléculas orgánicas, como los aminoácidos y los nucleótidos, mientras que el fósforo es un componente clave del ADN y del ATP.
Grupo 16: Calcógenos
Los elementos del grupo 16 tienen 6 electrones de valencia. Entre ellos se encuentra el oxígeno (O), un elemento esencial para la respiración celular y para la formación de agua. El azufre (S) y el selenio (Se) son otros elementos de este grupo que desempeñan diversos roles en los sistemas biológicos.
Grupo 17: Halógenos
Los halógenos son los elementos del grupo 17 y tienen 7 electrones de valencia. Estos elementos son altamente reactivos y tienden a ganar un electrón para alcanzar la configuración estable de gas noble con 8 electrones de valencia. El cloro (Cl), el bromo (Br) y el yodo (I) son algunos ejemplos de halógenos.
Grupo 18: Gases nobles
Finalmente, los gases nobles o inertes del grupo 18 tienen 8 electrones de valencia, excepto el helio (He), que tiene sólo 2. Estos elementos son extremadamente estables debido a su configuración electrónica completa. Los gases nobles, como el argón (Ar) y el xenón (e), rara vez forman enlaces químicos debido a su falta de reactividad.
Comprender el número de electrones de valencia en los diferentes grupos principales de la tabla periódica es crucial para entender cómo los elementos interactúan entre sí y cómo se forman los enlaces químicos. Estos electrones determinan las propiedades químicas y el comportamiento de los elementos, lo cual es fundamental en el estudio y la aplicación de la química en nuestro mundo.
Cómo se representan los electrones de valencia en un diagrama de Lewis
Los electrones de valencia juegan un papel crucial en el mundo de la química, ya que determinan las propiedades y reactividad de los átomos. Estos electrones son los que se encuentran en el nivel más externo de un átomo y están disponibles para formar enlaces químicos con otros átomos. En otras palabras, son los responsables de las interacciones entre átomos que dan lugar a la formación de moléculas.
Para representar los electrones de valencia de un átomo en un diagrama de Lewis, se utilizan símbolos especiales. Estos diagramas son una forma gráfica de representar la estructura electrónica de un átomo o una molécula, mostrando los electrones de valencia como puntos alrededor del símbolo del elemento.
Pasos para representar los electrones de valencia en un diagrama de Lewis:
- Identificar el elemento químico y determinar su número atómico. Este número indica la cantidad total de electrones presentes en un átomo neutro.
- Determinar el número de electrones de valencia del elemento. En general, los elementos de la misma columna en la tabla periódica tienen la misma cantidad de electrones de valencia.
- Dibujar el símbolo del elemento en el centro de la representación. Por ejemplo, para el carbono se representaría con la letra C.
- Agregar los electrones de valencia alrededor del símbolo del elemento. Cada punto representa un electrón de valencia. Se colocan un máximo de dos electrones en cada lado del símbolo, antes de comenzar a duplicarlos.
- Comprobar que se hayan utilizado todos los electrones de valencia. En un átomo neutro, el número total de puntos alrededor del símbolo debe ser igual al número de electrones de valencia determinado previamente.
Es importante destacar que en los diagramas de Lewis se representan únicamente los electrones de valencia; los electrones de los niveles más internos no se incluyen en este tipo de representaciones. Los electrones de los niveles internos completan la estructura electrónica del átomo, pero no participan directamente en las reacciones químicas.
Los diagramas de Lewis son una herramienta útil para comprender las interacciones entre átomos y predecir la formación de enlaces químicos. A través de ellos, es posible visualizar cómo los electrones de valencia se comparten o se transfieren entre los átomos para alcanzar una mayor estabilidad y configuración electrónica similar a la de los gases nobles. Esta configuración estable es conocida como regla del octeto.
Los electrones de valencia son fundamentales para entender la química, y los diagramas de Lewis nos permiten representar de forma clara y concisa la estructura electrónica y los enlaces químicos que se forman entre los átomos.
Cuáles son las reglas para determinar el número de electrones de valencia de un elemento
Los electrones de valencia son aquellos que ocupan el nivel más externo de un átomo y determinan las propiedades químicas de un elemento. Son fundamentales para entender cómo se combinan los átomos para formar moléculas y compuestos. Para determinar el número de electrones de valencia de un elemento, se siguen ciertas reglas establecidas por la tabla periódica.
Regla del grupo
La posición de un elemento en la tabla periódica indica directamente el número de electrones de valencia que tiene. Por ejemplo, los elementos en el grupo 1 tienen un electrón de valencia, mientras que los del grupo 2 tienen dos.
Regla del período
El número de electrones de valencia también está relacionado con el periodo al que pertenece un elemento. Cada período corresponde a un nivel de energía diferente. En general, los elementos pertenecientes al mismo periodo tienen el mismo número de niveles de energía y, por lo tanto, el número de electrones de valencia aumenta gradualmente de izquierda a derecha en un periodo.
Excepciones en la distribución electrónica
Aunque las reglas anteriores se aplican a la mayoría de los elementos, existen algunas excepciones debido a ciertos aspectos de la estructura electrónica. Por ejemplo, algunos elementos de transición tienen diferentes formas en las que sus electrones están distribuidos en los subniveles, lo que afecta su número de electrones de valencia.
Determinación del número de electrones de valencia
Para determinar el número de electrones de valencia de un elemento específico, se puede utilizar la notación de configuración electrónica. Al observar el último nivel de energía o la última letra o número en la configuración electrónica, podemos identificar cuántos electrones están en el nivel más externo y, por lo tanto, determinar el número de electrones de valencia.
Los electrones de valencia son esenciales para entender cómo los átomos interactúan entre sí y se combinan para formar compuestos químicos. Siguiendo las reglas establecidas por la tabla periódica, podemos determinar fácilmente el número de electrones de valencia de un elemento específico, lo que nos permite predecir su comportamiento químico y sus propiedades.
Cómo influyen los electrones de valencia en la formación de enlaces químicos
Los electrones de valencia juegan un papel crucial en la formación de enlaces químicos. Estos electrones son los ubicados en la capa más externa de un átomo y son los responsables de las interacciones entre los átomos para poder unirse y formar compuestos químicos.
La cantidad de electrones de valencia que tiene un átomo determinado se puede encontrar en su configuración electrónica. Estos electrones de valencia son los que participan en los procesos de enlace químico, ya sea compartiendo electrones con otros átomos o transfiriéndolos completamente mediante una reacción de transferencia de electrones.
Enlaces iónicos
Uno de los tipos más comunes de enlaces químicos es el enlace iónico, donde un átomo dona electrones de valencia a otro átomo que los acepta. Esto ocurre cuando hay una gran diferencia de electronegatividad entre ambos átomos, lo que significa que uno tiene una mayor atracción por los electrones que el otro.
El átomo que dona los electrones se convierte en un ion cargado positivamente (catión) debido a la pérdida de electrones, mientras que el átomo que los acepta se convierte en un ion cargado negativamente (anión). Estos iones luego se atraen mutuamente debido a sus cargas opuestas y forman una estructura cristalina sólida llamada compuesto iónico.
Un ejemplo clásico de un enlace iónico es el cloruro de sodio (NaCl), donde el sodio dona un electrón a un átomo de cloro para formar los iones Na+ y Cl-. La atracción electrostática entre estos iones mantiene unidos a los átomos en una red cristalina.
Enlaces covalentes
Otro tipo común de enlace químico es el enlace covalente, donde dos átomos comparten electrones de valencia. Esto ocurre cuando no hay una gran diferencia de electronegatividad entre los átomos involucrados. En lugar de donar o aceptar electrones por completo, los átomos comparten sus electrones de valencia para completar sus capas exteriores.
Existen diferentes tipos de enlaces covalentes, como los enlaces covalentes simples, dobles y triples, que se diferencian en la cantidad de electrones que se comparten entre los átomos. En los enlaces covalentes simples, los átomos comparten un par de electrones, mientras que en los dobles comparten dos pares de electrones, y en los triples comparten tres pares de electrones. Estos enlaces fuertes mantienen a los átomos unidos y forman moléculas estables.
Un ejemplo de enlace covalente es el agua (H2O), donde cada átomo de hidrógeno comparte un par de electrones con el átomo de oxígeno. Esta estructura molecular estable permite que ocurran importantes interacciones químicas, como las reacciones de descomposición del agua en oxígeno e hidrógeno mediante electrólisis.
Enlaces metálicos
Los enlaces metálicos son otra forma de enlace químico donde los electrones de valencia se comparten entre muchos átomos. Esto ocurre principalmente en los metales, donde los electrones de valencia tienen una alta movilidad y no están fuertemente atraídos por un átomo en particular.
En los metales, los átomos forman una red cristalina donde los electrones de valencia se mueven libremente a través de la estructura metálica. Estos electrones, conocidos como "electrones libres" o "mar de electrones", son responsables de las excelentes propiedades conductoras de los metales, como la conductividad eléctrica y térmica.
Un ejemplo clásico de un enlace metálico es el cobre (Cu), donde los átomos de cobre forman una estructura cristalina de ions positivos de cobre y electrones libres. Esta estructura compacta permite que los electrones se muevan fácilmente, lo que da lugar a la excelente conductividad del cobre.
Los electrones de valencia desempeñan un papel crucial en la formación de enlaces químicos. Ya sea a través de donar, aceptar o compartir electrones, estos electrones permiten que los átomos se unan y formen compuestos estables. Los diferentes tipos de enlaces químicos, como los iónicos, covalentes y metálicos, dependen de cómo los electrones de valencia interactúen entre sí. Comprender la función de los electrones de valencia en los enlaces químicos es fundamental para entender la química y cómo se forman los diferentes compuestos en el mundo que nos rodea.
Qué son los ejemplos comunes de compuestos químicos que muestran la importancia de los electrones de valencia
Los electrones de valencia desempeñan un papel crucial en el mundo de la química. Son los electrones que se encuentran en la capa más externa de un átomo y determinan las propiedades químicas de los elementos. Estos electrones son responsables de la formación de enlaces químicos y juegan un papel fundamental en la reactividad y comportamiento químico de las sustancias.
Existen numerosos ejemplos de compuestos químicos que demuestran la importancia de los electrones de valencia. Uno de los ejemplos más comunes es el agua (H2O). El oxígeno tiene 6 electrones de valencia, mientras que el hidrógeno tiene 1 electrón de valencia. Al unirse dos átomos de hidrógeno con un átomo de oxígeno a través de enlaces covalentes, se forman moléculas de agua. Los electrones de valencia del oxígeno se comparten entre los átomos de hidrógeno, lo que da como resultado una molécula con una estructura angular y propiedades únicas como la alta capacidad para disolver muchas sustancias.
Otro ejemplo es el cloruro de sodio (NaCl), también conocido como sal de mesa. En este caso, el sodio tiene 1 electrón de valencia, mientras que el cloro tiene 7 electrones de valencia. Al unirse un átomo de sodio con un átomo de cloro a través de un enlace iónico, se forma el cloruro de sodio. El átomo de sodio pierde su electrón de valencia, que es transferido al átomo de cloro. Este intercambio de electrones resulta en la formación de una estructura cristalina en la que los iones de sodio y cloruro están fuertemente atraídos entre sí.
Un ejemplo más complejo es el dióxido de carbono (CO2). Cada átomo de carbono tiene 4 electrones de valencia, mientras que cada átomo de oxígeno tiene 6 electrones de valencia. En el dióxido de carbono, dos átomos de oxígeno se unen con un átomo de carbono a través de enlaces covalentes dobles. Los electrones de valencia se comparten entre los átomos, lo que da como resultado una molécula lineal con ángulos de enlace característicos. El dióxido de carbono es conocido por su contribución al efecto invernadero y su importancia en el ciclo del carbono en la Tierra.
Estos son solo algunos ejemplos comunes de compuestos químicos que demuestran la importancia de los electrones de valencia en la química. Los electrones de valencia juegan un papel fundamental en la determinación de las propiedades químicas de las sustancias y son responsables de la formación de enlaces químicos. Su comprensión es crucial para comprender y manipular las reacciones químicas y los compuestos encontrados en la naturaleza.
Qué papel juegan los electrones de valencia en la conducción eléctrica
Los electrones de valencia desempeñan un papel crucial en la conducción eléctrica. Estos electrones de valencia, que se encuentran en el nivel más externo de un átomo, son los responsables de las propiedades conductoras de los materiales.
Cuando un material tiene electrones de valencia libres, es capaz de conducir la corriente eléctrica de manera eficiente. Esto se debe a que los electrones de valencia pueden moverse fácilmente a través del material, creando un flujo de cargas eléctricas.
En contraste, los materiales que no tienen electrones de valencia libres no pueden conducir la electricidad de forma efectiva. Esto se debe a que los electrones de valencia están fuertemente ligados al núcleo del átomo y no pueden desplazarse con facilidad.
Estructura de bandas y conductividad eléctrica
La capacidad de un material para conducir la electricidad está directamente relacionada con su estructura de bandas. La estructura de bandas describe la distribución de energía electrónica en un material.
En un material conductor, como el cobre o el aluminio, la estructura de bandas permite que los electrones de valencia se muevan libremente a través del material. En estos materiales, existe una superposición de bandas de energía, lo que permite a los electrones saltar de una banda a otra sin mucha resistencia. Esto facilita la conducción eléctrica.
Por otro lado, en un material aislante, como el vidrio o el plástico, existe una brecha de energía entre las bandas ocupadas por los electrones y las bandas desocupadas. Esta brecha de energía es demasiado grande para que los electrones de valencia puedan saltar a la banda vacante, lo que impide la conducción eléctrica.
En el caso de los semiconductores, como el silicio o el germanio, la estructura de bandas se encuentra entre la de los conductores y los aislantes. Estos materiales tienen una pequeña brecha de energía, que puede ser superada mediante el suministro de una cantidad suficiente de energía externa. Esto les confiere cierta capacidad de conducción eléctrica, lo que los hace ideales para aplicaciones en dispositivos electrónicos.
Importancia en la química
Los electrones de valencia también son fundamentales en la formación de enlaces químicos. Cuando dos átomos se unen para formar una molécula, los electrones de valencia son los que participan en esta interacción. Estos electrones se comparten, cedidos o recibidos por los átomos para formar enlaces covalentes, iónicos o metálicos.
Además, la configuración de electrones de valencia de un átomo determina su reactividad química. Los átomos tienden a completar su capa de electrones de valencia a través de la adquisición o pérdida de electrones, buscando alcanzar una configuración más estable. Esto explica la formación de iones positivos (cationes) y negativos (aniones) en los procesos químicos.
Los electrones de valencia desempeñan un papel esencial en la conducción eléctrica y la formación de enlaces químicos. Su comportamiento y capacidad para moverse libremente determinan las propiedades conductoras de los materiales, así como la reactividad química de los átomos. El estudio de los electrones de valencia es fundamental en el campo de la química y tiene importantes implicaciones en diversas áreas, como la electrónica y los materiales.
Cuál es la importancia de los electrones de valencia en la formación de iones
Los electrones de valencia juegan un papel crucial en la formación de iones, lo que a su vez tiene un impacto significativo en el mundo de la química. Los electrones de valencia son los electrones ubicados en la capa más externa de un átomo y son responsables de los enlaces químicos.
Cuando se forma un enlace entre dos átomos, los electrones de valencia de cada átomo interactúan entre sí. Pueden ser compartidos entre los átomos (en enlaces covalentes) o transferidos por completo de un átomo a otro (en enlaces iónicos). En el caso de los enlaces iónicos, es importante destacar la influencia de los electrones de valencia en la formación de los iones.
Un ion es un átomo o una molécula que ha perdido o ganado uno o varios electrones. Esto da como resultado una carga eléctrica desequilibrada, lo que hace que el ion sea un imán para otros átomos o moléculas que tienen una carga opuesta.
Cuando un átomo pierde uno o varios electrones de valencia, se convierte en un ion positivo o catión. Por el contrario, cuando un átomo gana uno o varios electrones de valencia, se convierte en un ion negativo o anión. Estos iones cargados pueden atraerse unos a otros debido a las fuerzas electrostáticas resultantes de sus cargas opuestas.
La capacidad de los electrones de valencia para ser transferidos o compartidos durante la formación de enlaces químicos es fundamental para la estabilidad de los compuestos químicos. Los enlaces iónicos y covalentes formados mediante las interacciones de los electrones de valencia permiten la creación de compuestos químicos estables y diversas sustancias.
Además, los iones formados gracias a los electrones de valencia tienen un impacto significativo en las propiedades químicas de las sustancias. Por ejemplo, los iones positivos son más propensos a reaccionar con los iones negativos para formar compuestos iónicos. Estos compuestos pueden tener puntos de fusión y ebullición altos, ya que las fuerzas electrostáticas entre los iones requieren una gran cantidad de energía para romperse.
Los electrones de valencia desempeñan un papel clave en la formación de iones y en la estabilidad de los compuestos químicos. Su capacidad para ser transferidos o compartidos durante la formación de enlaces químicos permite la creación de sustancias variadas y contribuye a las propiedades químicas únicas de los compuestos resultantes.
Los electrones de valencia son los electrones más externos en la capa de valencia de un átomo, y juegan un papel crucial en las reacciones químicas.
Los electrones de valencia determinan las propiedades químicas de un átomo y su capacidad para formar enlaces con otros átomos. Son responsables de la mayoría de las interacciones químicas.
El número de electrones de valencia se representa mediante puntos o cruces alrededor del símbolo del elemento en la estructura de Lewis.
Los elementos de la tabla periódica tienen diferentes números de electrones de valencia. Por ejemplo, los elementos del Grupo 1 tienen 1 electrón de valencia, mientras que los del Grupo 18 (gases nobles) tienen 8 electrones de valencia.
Cuando un átomo gana electrones de valencia, forma un anión cargado negativamente. Por otro lado, si pierde electrones de valencia, forma un catión cargado positivamente. Estas interacciones electrónicas son fundamentales en la formación de compuestos químicos y reacciones químicas.

Entradas relacionadas