Descubre cómo identificar fácilmente el reactivo limitante en una reacción química
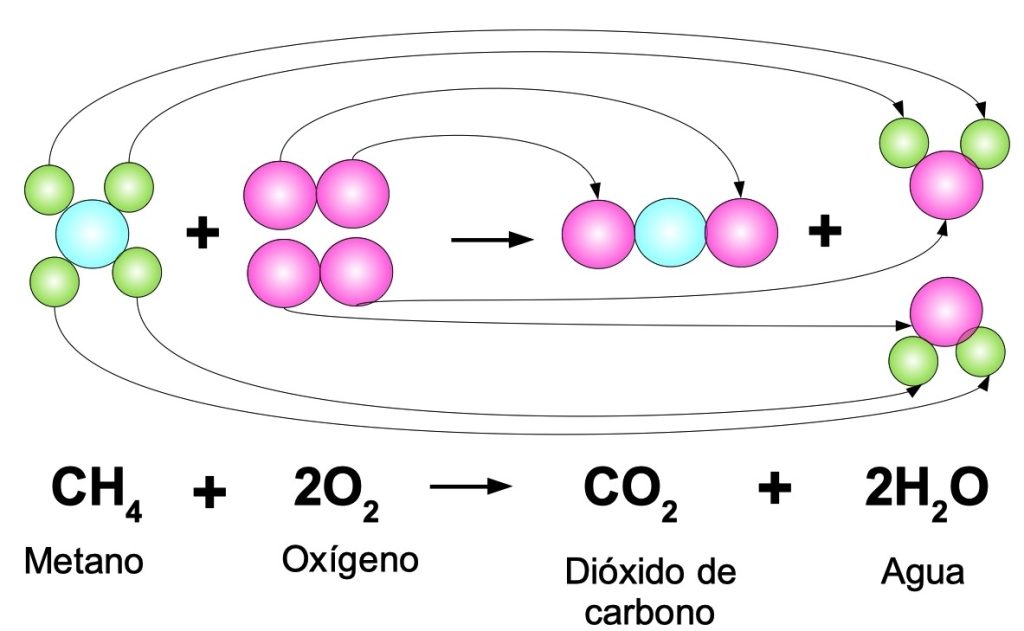
En química, el reactivo limitante es aquel que se agota primero durante una reacción química y determina la cantidad máxima de producto que puede formarse. Identificar el reactivo limitante es crucial para calcular de manera precisa la cantidad de productos obtenidos en una reacción. Por lo tanto, es importante saber cómo identificar fácilmente el reactivo limitante en una reacción química.
Te mostraremos algunas estrategias útiles para determinar cuál es el reactivo limitante en una reacción química. Explicaremos cómo calcular las moles o gramos de cada reactivo y cómo utilizar estas cantidades para determinar cuánto de cada reactivo se necesita. Además, discutiremos el uso del concepto de relación estequiométrica para identificar el reactivo limitante y cómo realizar los cálculos necesarios para obtener el rendimiento máximo de producto en una reacción química.
- Qué es un reactivo limitante en una reacción química
- Cómo se puede identificar el reactivo limitante de manera sencilla
- Cuál es la importancia de conocer el reactivo limitante en una reacción química
- Cuáles son los pasos a seguir para determinar el reactivo limitante en una ecuación química
- Qué ocurre si añadimos un exceso de un reactivo que no es el limitante
- Cuáles son las implicaciones prácticas de saber identificar el reactivo limitante en la industria química
- Qué factores pueden complicar la identificación del reactivo limitante
- Existen métodos alternativos o simplificados para determinar el reactivo limitante en una reacción
- Preguntas frecuentes (FAQ)
- 1. ¿Qué es el reactivo limitante en una reacción química?
- 2. ¿Cómo puedo identificar el reactivo limitante en una reacción química?
- 3. ¿Cuál es la importancia de identificar el reactivo limitante en una reacción química?
- 4. ¿Qué sucede si añado más cantidad del reactivo limitante a una reacción química?
- 5. ¿Debo considerar factores como la temperatura o la presión al identificar el reactivo limitante?
Qué es un reactivo limitante en una reacción química
Un reactivo limitante en una reacción química es aquel que se agota por completo antes de que se puedan consumir todos los demás reactivos presentes en la mezcla. En otras palabras, es el reactivo que determina la cantidad máxima de producto que se puede obtener en una reacción.
Cómo identificar el reactivo limitante
Identificar el reactivo limitante en una reacción química es fundamental para calcular las cantidades exactas de productos que se pueden formar. A continuación te presento algunos pasos sencillos para ayudarte a identificar el reactivo limitante:
- 1. Balancea la ecuación química de la reacción: Este paso es clave para asegurarte de que la ecuación esté correctamente balanceada y conocer la proporción estequiométrica en la que los reactivos se combinan. Asegúrate de que el número de átomos de cada elemento sea igual en ambos lados de la ecuación.
- 2. Calcula la cantidad de moles de cada reactivo: Utiliza las masas moleculares de los reactivos y las cantidades dadas en la ecuación química para convertir las unidades (gramos, miligramos, kilogramos, etc.) a moles. Esto te permitirá comparar directamente las cantidades de los diferentes reactivos.
- 3. Determina la relación estequiométrica entre los reactivos: Analiza la proporción molar entre los reactivos en base a la ecuación química balanceada. Esto te indicará cuántos moles de un reactivo reaccionarán con cierta cantidad de moles del otro reactivo.
- 4. Calcula los moles de producto para cada reactivo: Utiliza la relación estequiométrica encontrada en el paso anterior para determinar cuántos moles de producto se pueden obtener a partir de cada reactivo, asumiendo que todos los reactivos se consumen por completo.
- 5. Compara los moles de producto obtenidos: Observa los resultados obtenidos en el paso anterior y compara los moles de producto generados a partir de cada reactivo. El reactivo que genere la menor cantidad de producto será el reactivo limitante.
Es importante tener en cuenta que, una vez identificado el reactivo limitante, cualquier cantidad adicional de ese reactivo no contribuirá a aumentar la cantidad de producto obtenido. Por lo tanto, es necesario utilizar las cantidades correctas de reactivo limitante y otros reactivos en proporción estequiométrica para obtener los mejores resultados en una reacción química.
Cómo se puede identificar el reactivo limitante de manera sencilla
Una de las tareas fundamentales en química es la determinación del reactivo limitante en una reacción química. Este concepto resulta crucial para conocer cuál de los reactivos se va a consumir completamente y, por lo tanto, va a determinar cuánta cantidad de producto se puede obtener.
Identificar el reactivo limitante puede parecer complicado al principio, pero existen técnicas sencillas que nos permiten hacerlo de manera precisa. A continuación, te presentaremos algunas estrategias y consejos útiles para llevar a cabo esta tarea con facilidad.
Paso 1: Obtener las ecuaciones balanceadas
Lo primero que debemos hacer es obtener las ecuaciones químicas balanceadas para la reacción en cuestión. Esto implica asegurarnos de que el número de átomos de cada elemento sea igual en ambos lados de la ecuación. Esta etapa es fundamental, ya que será la base para el resto del proceso de identificación.
Paso 2: Comparar las moles y relaciones estequiométricas
Una vez que tenemos las ecuaciones balanceadas, debemos comparar las moles y las relaciones estequiométricas de los reactivos. Para ello, utilizaremos los coeficientes estequiométricos de la ecuación química.
El coeficiente estequiométrico es el número que acompaña a cada sustancia en la ecuación química balanceada. Esta cifra indica la relación molar entre los distintos reactivos y productos. Por ejemplo, si tenemos la siguiente ecuación:
2H2 (g) + O2 (g) → 2H2O (l)
Podemos observar que la relación entre el hidrógeno y el oxígeno es de 2 a 1. Esto significa que se necesitan dos moles de hidrógeno por cada mol de oxígeno para obtener dos moles de agua.
Una vez que hemos establecido la relación estequiométrica, podemos comparar las cantidades de los reactivos disponibles en la reacción. Generalmente, estas cantidades se dan en gramos o moles.
Paso 3: Calcular las moles disponibles
El siguiente paso consiste en calcular las moles disponibles para cada uno de los reactivos. Esto implica utilizar las masas moleculares de las sustancias y realizar conversiones adecuadas para obtener las moles correspondientes.
Por ejemplo, si tenemos 10 gramos de hidrógeno (H2) y queremos saber cuántas moles hay, utilizaremos la fórmula:
moles = masa / masa molar
La masa molar del hidrógeno es de aproximadamente 2 g/mol, por lo que el cálculo sería:
moles = 10 g / 2 g/mol = 5 moles
Repetiremos este cálculo para todos los reactivos involucrados en la reacción y anotaremos las moles obtenidas para cada uno de ellos.
Paso 4: Comparar las moles disponibles
Una vez que tenemos las moles disponibles para cada reactivo, es momento de compararlas. El reactivo limitante será aquel que tenga la menor cantidad de moles disponibles.
Por ejemplo, si tenemos 5 moles de hidrógeno y 4 moles de oxígeno en la misma reacción, podemos afirmar que el hidrógeno es el reactivo limitante. Esto se debe a que la relación estequiométrica indica que se necesitan 2 moles de hidrógeno por cada mol de oxígeno, por lo que los moles de hidrógeno son insuficientes para reaccionar con el total de oxígeno disponible.
Es importante destacar que el reactivo limitante determinará la cantidad máxima de producto que se puede obtener. En este caso, si el hidrógeno es el reactivo limitante, solo podríamos obtener un máximo de 2 moles de agua.
Paso 5: Verificar el reactivo en exceso
Una vez identificado el reactivo limitante, es importante verificar cuál será el reactivo en exceso. Este reactivo será aquel que no se consuma completamente al final de la reacción.
Para encontrarlo, puedes utilizar la cantidad de moles disponibles para los reactivos y la relación estequiométrica establecida en la ecuación química balanceada.
En nuestro ejemplo anterior, sabemos que tenemos 5 moles de hidrógeno y necesitamos 2 moles de hidrógeno por cada mol de oxígeno. Por lo tanto, si utilizamos los 4 moles de oxígeno disponibles, necesitaríamos 8 moles de hidrógeno para reaccionar completamente con todo el oxígeno. Como solo tenemos 5 moles de hidrógeno, quedará un exceso de 3 moles de oxígeno al final de la reacción.
Es importante conocer el reactivo en exceso, ya que nos permitirá determinar si se está utilizando de manera eficiente o si es necesario ajustar las cantidades de los reactivos para obtener una mayor cantidad de producto.
Identificar el reactivo limitante en una reacción química puede ser sencillo si seguimos estos pasos. A través de la comparación de las moles y las relaciones estequiométricas, podemos determinar cuál de los reactivos se va a consumir por completo y, por lo tanto, va a limitar la cantidad de producto obtenido. Recuerda siempre hacer los cálculos adecuados y utilizar las ecuaciones químicas balanceadas como guía durante el proceso.
Cuál es la importancia de conocer el reactivo limitante en una reacción química
Para comprender la importancia de identificar el reactivo limitante en una reacción química, es fundamental entender el concepto mismo de reactivo limitante. En toda reacción química, los reactivos se consumen en proporciones estequiométricas, lo que significa que deben estar presentes en la cantidad exacta necesaria para que todas las sustancias reaccionen entre sí de manera completa y balanceada.
Sin embargo, en muchas ocasiones ocurre que alguno de los reactivos está presente en una cantidad mayor a la necesaria, mientras que otro reactivo está presente en una cantidad más reducida. Este reactivo presente en menor cantidad es lo que se conoce como reactivo limitante.
Identificar el reactivo limitante es crucial debido a que determina la cantidad máxima de producto que se puede obtener en una reacción química. Si no se conoce cuál es el reactivo limitante, se corre el riesgo de desperdiciar los reactivos, obteniendo una menor cantidad de producto del que podría obtenerse.
Además, conocer el reactivo limitante permite hacer cálculos precisos de rendimiento y eficiencia en un laboratorio o en una industria. Esto es especialmente importante cuando se trabaja con sustancias costosas o se busca maximizar la producción.
Existen varias formas de identificar el reactivo limitante en una reacción química. Una de las técnicas más utilizadas es el cálculo de moles, que involucra el uso de las proporciones estequiométricas para determinar cuántos moles de cada reactivo se necesitan y comparar con la cantidad disponible.
Otra opción es observar la estequiometría de la reacción y determinar cuál de los reactivos se consume en menor cantidad. Esto se puede hacer mediante la comparación de las relaciones molares entre los reactivos y el producto deseado.
Identificar el reactivo limitante en una reacción química es esencial para tener un control adecuado sobre la cantidad y calidad de los productos obtenidos. Esta información permite optimizar los procesos químicos, reducir costos y maximizar eficiencia. Por lo tanto, es fundamental para cualquier químico o profesional que trabaje en el campo de la química saber cómo identificar el reactivo limitante en una reacción química.
Cuáles son los pasos a seguir para determinar el reactivo limitante en una ecuación química
Identificar el reactivo limitante en una reacción química es un paso crucial para poder calcular correctamente las cantidades de productos formados. El reactivo limitante es aquel que se agota primero durante la reacción, lo que significa que determinará la cantidad máxima de producto que se puede obtener.
Paso 1: Escribir y balancear la ecuación química
El primer paso para determinar el reactivo limitante es escribir y balancear correctamente la ecuación química de la reacción. Esto implica asegurarse de que haya igual número de átomos de cada elemento tanto en los reactivos como en los productos. Por ejemplo, si tenemos la reacción:
2H2 + O2 → 2H2O
Aquí podemos ver que hay dos átomos de hidrógeno en cada lado de la flecha y también dos átomos de oxígeno, por lo que la ecuación está balanceada.
Paso 2: Calcular las moles de cada reactivo
Una vez que tenemos la ecuación química balanceada, el siguiente paso es calcular las moles de cada uno de los reactivos. Para hacer esto, utilizamos la masa molar de cada elemento y la cantidad dada del reactivo. La masa molar se puede encontrar en la tabla periódica y representa la masa de un mol de átomos de ese elemento.
Por ejemplo, si queremos determinar el reactivo limitante en la reacción anterior y tenemos 4 moles de H2 y 3 moles de O2, podemos usar las siguientes conversiones:
4 moles H2 = 4 * (2 g/mol H2) = 8g H23 moles O2 = 3 * (32 g/mol O2) = 96g O2
Estos cálculos nos dan la masa de cada reactivo.
Paso 3: Determinar las moles de producto formadas
A continuación, debemos determinar cuántas moles de producto se pueden obtener a partir de cada uno de los reactivos. Para hacer esto, utilizamos las relaciones estequiométricas que se encuentran en la ecuación balanceada.
En el ejemplo anterior, podemos ver que para formar dos moles de H2O, se requieren dos moles de H2 y un mol de O2. Por lo tanto:
4 moles H2 → 2 moles H2O3 moles O2 → 1 mole H2O
Podemos utilizar estas relaciones para calcular la cantidad máxima de producto que se puede formar a partir de cada uno de los reactivos.
Paso 4: Comparar las cantidades de producto obtenidas
Una vez que hemos calculado las moles de producto formadas a partir de cada uno de los reactivos, el siguiente paso es comparar estas cantidades. El reactivo limitante será aquel que produzca la menor cantidad de producto.
En el ejemplo anterior, si calculamos las moles de H2O formadas a partir de los 8g de H2 y los 96g de O2, obtendremos:
8g H2 → 4 moles H2O96g O2 → 3 moles H2O
Podemos ver que el H2 produce una mayor cantidad de H2O, por lo que el reactivo limitante en esta reacción es el O2.
Paso 5: Calcular las cantidades de los otros productos
Una vez que hemos determinado el reactivo limitante, podemos utilizar estas moles para calcular las cantidades de los otros productos. Para ello, utilizamos las relaciones estequiométricas de la ecuación química balanceada.
En el ejemplo anterior, si tenemos un exceso de H2 y queremos calcular cuánta agua se puede formar a partir de 10g de H2, podemos usar la siguiente conversión:
10g H2 * (1mol/2g) * (2moles H2O/4moles H2) = 2.5g H2O
Por lo tanto, utilizando estas conversiones, podemos determinar las cantidades de los demás productos cuando conocemos el reactivo limitante.
Determinar el reactivo limitante en una reacción química es fundamental para poder calcular correctamente las cantidades de productos formados. Siguiendo estos pasos, podrás identificar fácilmente el reactivo limitante y obtener resultados precisos en tus cálculos estequiométricos.
Qué ocurre si añadimos un exceso de un reactivo que no es el limitante
En una reacción química, el reactivo limitante es aquel que se consume completamente y determina la cantidad máxima de producto que puede formarse. Sin embargo, en ocasiones podemos cometer el error de añadir un exceso de un reactivo que no es el limitante y esto puede tener consecuencias negativas en el proceso.
Si añadimos un exceso de un reactivo que no es el limitante, significa que estamos introduciendo más cantidad de dicho reactivo de la necesaria para completar la reacción. Esto podría llevar a un desequilibrio en la proporción de los reactivos y afectar la formación del producto final.
Uno de los problemas más comunes al añadir un exceso de reactivo no limitante es la formación de subproductos indeseados. Estos subproductos pueden generar residuos o contaminantes que afecten la pureza del producto final e incluso puedan ser perjudiciales para el medio ambiente.
Ejemplo:
Imaginemos una reacción química en la cual el reactivo limitante es A y el reactivo B es el no limitante. Si añadimos un exceso de B, este reactivo no será consumido por completo ya que la cantidad de A disponible es insuficiente para reaccionar con todo el B agregado. Como resultado, podremos encontrar un exceso de B sin reaccionar en el producto final de la reacción.
Además de la formación de subproductos indeseados, otro problema al añadir un exceso de reactivo no limitante es el desperdicio de recursos. Al introducir más cantidad de un reactivo del necesario, estaremos utilizando más materia prima de la que realmente se necesita para obtener el producto final. Esto implica un gasto innecesario de recursos como tiempo, energía y dinero.
Añadir un exceso de un reactivo que no es el limitante puede generar problemas como la formación de subproductos indeseados, el desperdicio de recursos y el desequilibrio en la proporción de los reactivos. Por ello, es importante identificar correctamente cuál es el reactivo limitante en una reacción química antes de proceder con cualquier adición de reactivos.
Cuáles son las implicaciones prácticas de saber identificar el reactivo limitante en la industria química
La capacidad de identificar el reactivo limitante en una reacción química es una habilidad fundamental en la industria química. Esto se debe a que conocer el reactivo limitante permite optimizar el proceso de producción y garantizar una eficiencia máxima en la obtención del producto deseado.
El reactivo limitante es aquel que está presente en menor cantidad en una reacción química y determina la cantidad máxima de producto que se puede obtener. Por lo tanto, si se utiliza un exceso de reactivo en comparación con el reactivo limitante, se desperdiciarán recursos y energía sin obtener un aumento significativo en la cantidad de producto obtenido.
Identificar el reactivo limitante es especialmente importante en la industria química, donde se manejan grandes volúmenes de sustancias y se busca maximizar la eficiencia de los procesos. Al conocer cuál es el reactivo limitante, se pueden ajustar las proporciones de los reactivos y optimizar las condiciones de reacción para obtener el máximo rendimiento posible.
Beneficios de saber identificar el reactivo limitante
- Optimización de recursos: conocer el reactivo limitante permite utilizar la cantidad adecuada de reactivos y evitar su desperdicio innecesario.
- Aumento de la eficiencia: al utilizar la cantidad óptima de reactivo limitante, se logra obtener la máxima cantidad de producto con la menor cantidad de recursos empleados.
- Reducción de costos: al optimizar los recursos utilizados, se reducen los costos asociados a la producción química.
- Mejora en la calidad del producto: al utilizar las proporciones adecuadas de reactivos, se asegura la obtención de un producto con las características deseadas.
- Mayor seguridad en los procesos: conocer el reactivo limitante permite evitar condiciones de operación peligrosas y prevenir posibles accidentes.
Identificar el reactivo limitante en una reacción química tiene importantes implicaciones prácticas en la industria química. Esta habilidad permite optimizar recursos, aumentar la eficiencia, reducir costos y mejorar la calidad del producto obtenido. Además, contribuye a garantizar la seguridad en los procesos químicos, evitando condiciones riesgosas. Por tanto, es crucial que los profesionales de la industria química dominen esta técnica para lograr resultados óptimos en sus operaciones.
Qué factores pueden complicar la identificación del reactivo limitante
Identificar el reactivo limitante en una reacción química puede resultar un poco complicado debido a diversos factores que pueden influir en este proceso. A continuación, mencionaremos algunos de los factores más comunes que pueden dificultar la identificación del reactivo limitante.
1. Relaciones estequiométricas
Uno de los factores que puede complicar la identificación del reactivo limitante es la falta de conocimiento sobre las relaciones estequiométricas entre los reactivos y productos de la reacción. La estequiometría es lo que nos permite calcular las cantidades de sustancias necesarias para una reacción química, y sin esta información adecuada, se vuelve difícil determinar cuál es el reactivo limitante.
2. Impurezas en los reactivos
Otro factor que puede generar confusión al identificar el reactivo limitante son las impurezas presentes en los reactivos. Estas impurezas pueden afectar la cantidad real del reactivo limitante presente en la muestra, lo que puede llevar a errores en los cálculos y conclusiones.
3. Reacciones secundarias o paralelas
La presencia de reacciones secundarias o paralelas también puede dificultar la identificación del reactivo limitante. Estas reacciones adicionales pueden competir con la reacción principal y consumir parte de los reactivos, haciendo más complicado determinar cuál de ellos es el limitante.
4. Condiciones variables de la reacción
Las condiciones en las que se lleva a cabo la reacción química también pueden influir en la identificación del reactivo limitante. Factores como la temperatura, la presión y el tiempo de reacción pueden modificar la velocidad y el equilibrio de la reacción, lo que a su vez puede afectar qué reactivo se consume por completo primero.
5. Fallos experimentales
Por último, es importante mencionar que los fallos experimentales también pueden complicar la identificación del reactivo limitante. Errores en las mediciones de las cantidades de reactivos, problemas de contaminación, imprecisión en los instrumentos de laboratorio, entre otros, pueden llevar a obtener resultados inexactos o contradictorios, dificultando así la determinación del reactivo limitante.
Todos estos factores deben tenerse en cuenta al intentar identificar el reactivo limitante en una reacción química. Es fundamental contar con un conocimiento sólido de las relaciones estequiométricas, llevar a cabo los experimentos en condiciones óptimas y realizar un análisis riguroso de los resultados obtenidos para poder determinar con precisión cuál es el reactivo limitante.
Existen métodos alternativos o simplificados para determinar el reactivo limitante en una reacción
A la hora de llevar a cabo una reacción química, es fundamental identificar el reactivo limitante para poder realizar un cálculo preciso de los productos obtenidos. Tradicionalmente, esto se ha hecho mediante cálculos estequiométricos y utilizando la proporción molar de los reactivos involucrados en la reacción. Sin embargo, existen métodos alternativos o simplificados que nos permiten determinar de manera más rápida y sencilla cuál es el reactivo limitante en una reacción.
1. Relación de moles
Un método simple pero efectivo para identificar el reactivo limitante es analizar la relación de moles de los reactivos que intervienen en la reacción. Para ello, se debe conocer la estequiometría de la reacción, es decir, las proporciones en las que se combinan los reactivos para formar los productos. A partir de esta información, se puede calcular la cantidad de moles de cada reactivo presente en la muestra y compararlas entre sí. El reactivo que esté presente en menor cantidad será el reactivo limitante.
2. Cálculo de rendimiento teórico
Otro método utilizado comúnmente para determinar el reactivo limitante es calcular el rendimiento teórico de cada uno de los reactivos. El rendimiento teórico se calcula a partir de la cantidad máxima de producto que se puede obtener según las proporciones estequiométricas de la reacción. Para calcular el rendimiento teórico de cada reactivo, se parte de la cantidad de moles de cada uno y se utiliza la estequiometría de la reacción para determinar cuántos moles del producto se pueden obtener a partir de esa cantidad. El reactivo que presente el menor rendimiento teórico será el reactivo limitante.
3. Experimentos de laboratorio
En ocasiones, la determinación del reactivo limitante puede requerir llevar a cabo experimentos de laboratorio en los que se pruebe la reacción con diferentes cantidades de reactivos. Esto puede resultar útil cuando los cálculos estequiométricos no son suficientes o cuando los reactivos presentan características particulares que dificultan la determinación mediante otros métodos. Realizando diversas pruebas y observando la formación de productos, se puede identificar cuál es el reactivo limitante en cada caso.
Existen diferentes métodos que nos permiten identificar fácilmente el reactivo limitante en una reacción química. Ya sea a través del análisis de las relaciones de moles, el cálculo del rendimiento teórico o mediante experimentos de laboratorio, es fundamental contar con esta información para poder realizar un cálculo preciso de los productos obtenidos. Utilizando estos métodos, los químicos pueden optimizar sus procesos y garantizar un mayor control sobre las reacciones químicas.
Preguntas frecuentes (FAQ)
1. ¿Qué es el reactivo limitante en una reacción química?
El reactivo limitante es el reactivo que se agota primero en una reacción química, impidiendo que los otros reactivos reactúen por completo.
2. ¿Cómo puedo identificar el reactivo limitante en una reacción química?
Para identificar el reactivo limitante, debes comparar los coeficientes estequiométricos de los reactivos y determinar cuál está presente en menor cantidad.
3. ¿Cuál es la importancia de identificar el reactivo limitante en una reacción química?
Identificar el reactivo limitante es importante para calcular la cantidad máxima de producto que se puede obtener en una reacción química.
4. ¿Qué sucede si añado más cantidad del reactivo limitante a una reacción química?
Agregar más cantidad del reactivo limitante no afectará la reacción química, ya que el exceso de este reactivo no podrá reaccionar con los otros reactivos.
5. ¿Debo considerar factores como la temperatura o la presión al identificar el reactivo limitante?
No, al identificar el reactivo limitante solo debes analizar las cantidades relativas de los reactivos involucrados, sin tener en cuenta factores externos como la temperatura o la presión.

Entradas relacionadas